Hydrogen Water
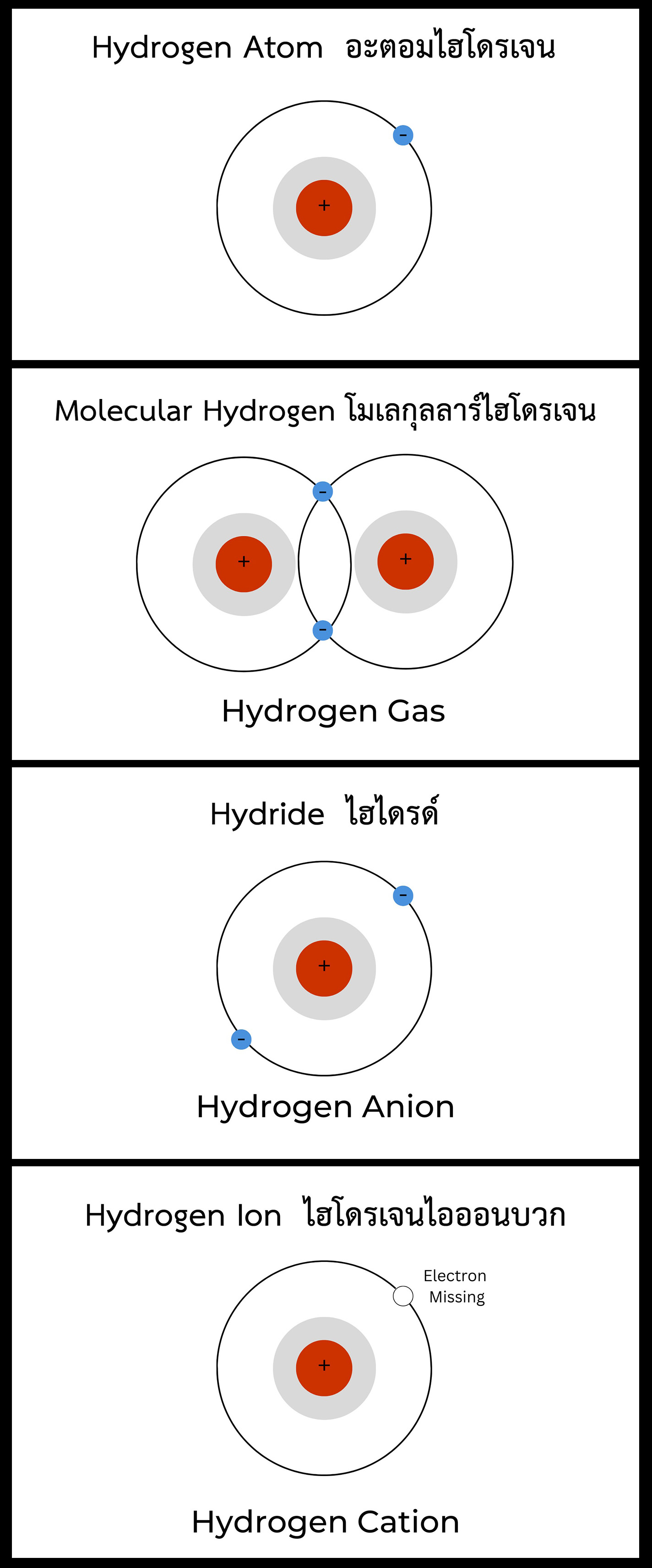
อะตอมไฮโดรเจน Hydrogen Atom - นึ่งอะตอมไฮโดรเจนหเป็นกลางและมีอิเล็กตรอนที่ไม่จับคู่ ดังนั้น จึงเป็นอนุมูลอิสระ ซึ่งเป็นสาเหตุที่อะตอมไฮโดรเจนจึงมียาก
โมเลกุลลาร์ไฮโดรเจน Molecular Hydrogen - ก๊าซไฮโดรเจนโมเลกุล หรือ H2 เป็นรูปแบบหลักของไฮโดรเจน อะตอมไฮโดรเจน 2 อะตอม (H) มีพันธะโควาเลนต์ ร่วมกันเป็น H-H เนื่องจากมีอะตอมไฮโดรเจน 2 อะตอม เราจึงเรียก ไดอะตอมิกไฮโดรเจน Diatomic Hydrogen (di หมายถึงสอง)
เนื่องจากอะตอมไฮโดรเจนมีพันธะโควาเลนต์ร่วมกัน จึงเกิดเป็นโมเลกุล ดังนั้น H2 จึงเรียกอีกอย่างหนึ่งว่า โมเลกุลลาร์ไฮโดรเจน หรืออาจเรียกว่า ไดอะตอมิกไฮโดรเจน ก็ได้
ไฮไดรด์ Hydride - ไฮไดรด์คืออะตอมไฮโดรเจนที่มีอิเล็กตรอนเพิ่มมา 1 ตัว มีโปรตอน 1 ตัวและอิเล็กตรอน 2 ตัว ทำให้เป็นไอออนลบเขียนเป็น H- เนื่องจากอะตอมไฮโดรเจนได้รับอิเล็กตรอนเพิ่มมา 1 ตัว จึงไม่มีอิเล็กตรอนที่ไม่จับคู่กัน ดังนั้นจึงไม่ใช่อนุมูลอิสระอีกต่อไป
ไฮโดรเจนไอออนบวก Hydrogen Cation - ไอออนไฮโดรเจนที่มีประจุบวก (H+ cation) ก็เรียกว่าเป็นโปรตอน เนื่องจากอะตอมไฮโดรเจนมีอิเล็กตรอนและโปรตอนเพียงตัวเดียว หากอะตอมสูญเสียอิเล็กตรอน ก็จะเป็นเพียงโปรตอนเท่านั้น
ไฮโดรเจนชนิดนี้เป็นตัวขับเคลื่อนเอนไซม์ ATP Synthase ในไมโตคอนเดรีย
ไฮโดรเจนไอออนบวก (H+) เป็นตัวกำหนดค่า pH ของน้ำ (คือ กรดหรือด่าง)
แต่ไฮโดรเจนจะมีการผลิตน้อยลง ตามอายุที่มากขึ้น เรื่องสุขภาพอาหารการกิน วิธีการใช้ชีวิตและปัจจัยอื่นๆ น้ำไฮโดรเจนถึงจะสามารถชดเชยไฮโดรเจนที่ผลิตน้อยลงในระบบลำไส้ และยังสามารถช่วยเพิ่มแบคทีเรียที่ผลิตก๊าซไฮโดรเจนในระบบลำไส้ในเวลาเดียวกัน